Выступая в феврале на Форуме будущих технологий, президент России Владимир Путин заявил, что российские ученые подошли к созданию так называемых онковакцин — вакцин против опухолей. Как работают эти «персональные» вакцины, что тормозит их разработку и когда ожидать их появления, RTVI рассказал замдиректора Федерального научно-клинического центра физико-химической медицины им. Ю.М. Лопухина ФМБА России Василий Лазарев.

Лазарев Василий Николаевич
Доктор биологических наук, заместитель генерального директора по научной работе, заведующий лабораторией генной инженерии ФГБУ ФНКЦ физико-химической медицины им. Ю.М.Лопухина ФМБА России, профессор кафедры молекулярной и трансляционной медицины МФТИ.
Работы Лазарева продемонстрировали эффективность «омиксных» (геномика, транскриптомика, протеомика, метаболомика) подходов для поиска новых соединений пептидной и белковой природы, на основе которых биотехнологическим синтезом можно создавать новые инновационные лекарственные препараты для лечения широкого круга социально-значимых заболеваний.
Автор более 200 научных трудов, среди них — более 100 статей, 12 патентов.
Ваш доклад на Форуме будущих технологий не остался незамеченным, особенно после того, как тезис о скором создании в России онковакцин повторил президент. Создание онковакцин предполагает персонализированный подход в лечении рака. Чем такой подход лучше традиционных?
Говорить о том, что персонифицированный подход лучше, чем стандартные методы терапии, нельзя, потому что стандартные методы терапии — и биологическая терапия, и химиотерапия — сейчас достаточно хорошо развиты и приносят свои результаты. Персонализированный подход более современный, почему он появился? Причина только одна — не бывает одинаковых заболеваний раком. Все опухоли отличаются друг от друга по своим молекулярным, генетическим характеристикам, особенностям роста, реакции на терапию и так далее. Поэтому персонализированный подход в онкологии перспективен и будет развиваться только на том основании, что каждая опухоль индивидуальна, но «волшебной пули» для всех типов рака как не было, так и не будет в перспективе.
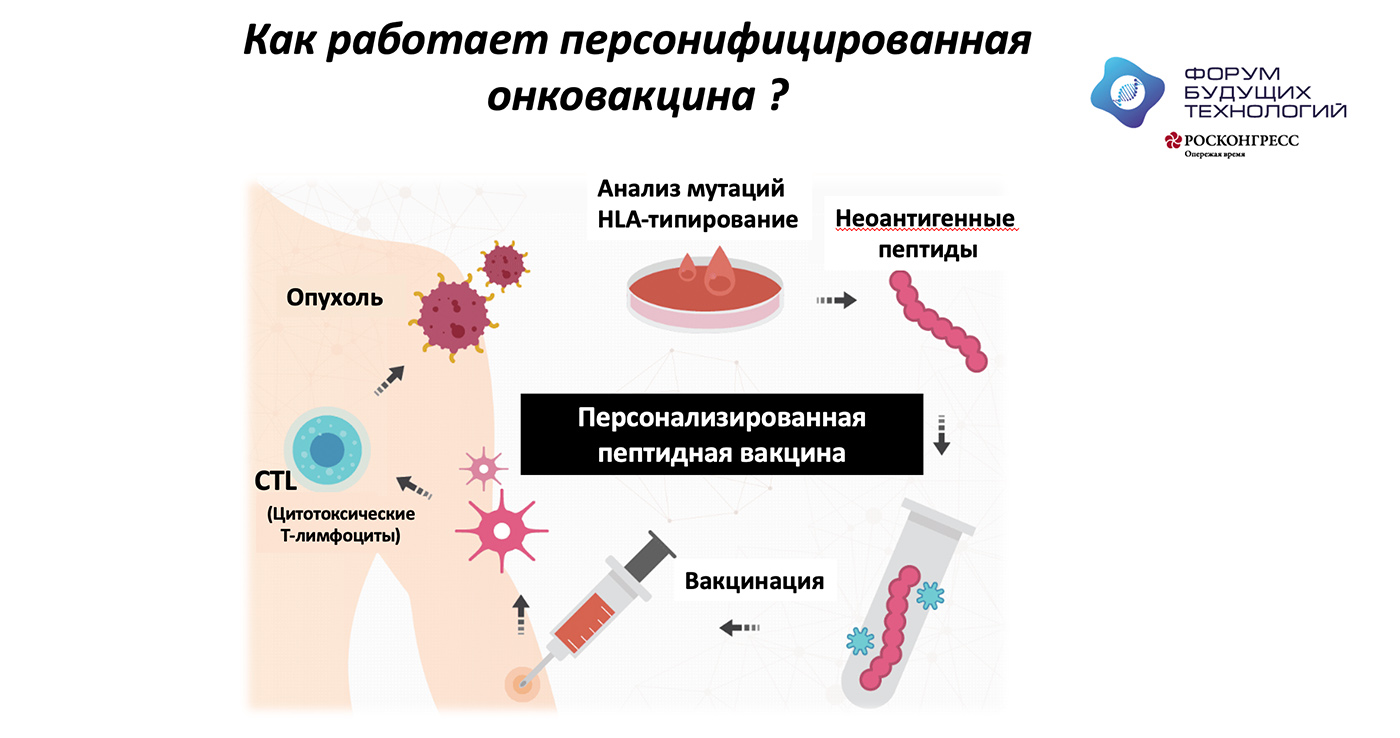
В чем состоит принцип работы неоантигенной вакцины?
Опухоль — это клетки организма, которые получили возможность бесконтрольно размножаться, потому что в них произошли мутации в определенных генах. Эти мутации как раз и определяют индивидуальность каждой опухоли. Эти гены есть и в здоровых тканях, но они не содержат этих мутаций. Антигены, которые являются продуктом мутированных генов, получили название «неоантигены».
Сначала мы изучаем молекулярно-генетические характеристики опухоли — с помощью секвенирования ДНК и РНК вычисляем, в каких именно генах опухолевой клетки произошли мутации. В то же время, мы секвенируем ДНК нормальных клеток, обычно клеток крови, чтобы отделить наследственные мутации, которые присутствуют у каждого человека, от мутаций в опухоли.
Дальше наша главная задача — направить иммунную систему организма на уничтожение тех клеток, в которых есть мутация, и при этом не затронуть здоровые клетки. Мы должны ввести в организм человека тем или иным образом эти неоантигены. Мы не вводим весь ген, содержащий мутацию, а вводим короткую последовательность, чтобы она распозналась иммунной системой, Т-лимфоцитами. Эта последовательность может быть введена в виде ДНК, РНК или пептидов.
На каком способе доставки остановились вы?
Мы остановились на пептидных неоантигенных вакцинах. Фактически после вычисления этих мутаций мы искусственно синтезируем пептиды, содержащие конкретные мутации.
Если сейчас секвенирование ДНК и РНК стало развито чрезвычайно широко и доступно по цене, то самым сложным остается обработка данных, предсказание эффективности тех пептидов, которые мы будем вводить.
И в этом вам помогает искусственный интеллект?
Что такое искусственный интеллект? Это программа, которая способна к обучению, и она мало отличается от тех программ, которые используем мы. То есть это предсказания, основанные на обучении. Эти программы предсказывают, насколько хорошо пептид свяжется с поверхностью клетки, и насколько он будет доступен для распознавания лимфоцитами.
Клинические исследования таких вакцин пока законодательно невозможны, какие доклинические исследования вы уже провели?
Мы занимаемся тремя типами рака — это колоректальный рак, глиобластома и меланома. Доклинические исследования были проведены на модели колоректального рака, чтобы доказать, что эти вакцины в принципе работоспособны. Доклиника была сделана на модели мышиного колоректального рака и человеческого рака на мышах, у которых собственная иммунная система была заменена на иммунную систему человека. Мышам была привита опухоль и вводился коктейль неоантигенных пептидов, после чего мы смотрели на их токсичность и оценивали регрессию опухоли.
Каковы результаты?
Выживаемость мышей увеличивалась на 70-80%.
А что с остальными двумя типами опухолей?
Наша цель- не вылечить мышиный рак, а вылечить человеческий. Эта модель рака была выбрана, чтобы проверить, работает ли наш подход, правильно ли мы выбираем пептиды, синтезируем, компонуем и вводим. Мы показали, что этот подход работает, и мы уверены, что он сработает и на меланоме и на глиобластоме.
В лечении каких типов рака в будущем, как вам представляется, неоантигенные вакцины будут наиболее эффективны?
Я думаю, что неоантигенные вакцины можно использовать при лечении любых, по крайней мере, солидных опухолей (не опухолей крови). Пока мы рассматриваем неоантигенные вакцины, как линию последней надежды, когда не срабатывает химиотерапия, когда у пациента запущенная стадия, и исчерпаны возможности лечения стандартных методов. Я думаю, что в перспективе, конечно же, вакцины могут и должны применяться на более ранних стадиях, чтобы не допустить распространения опухоли, не допустить метастазов.
Можно ли ожидать, что онковакцины приведут не к количественному, а качественному прорыву в лечении таких тяжелых форм рака, как глиобластома и рак поджелудочной железы, при которых пятилетняя выживаемость больных измеряется лишь несколькими процентами?
Да, конечно, это обязательно будет, и я хочу заметить, что не следует позиционировать неоантигенные вакцины как отдельный индивидуальный способ лечения. Они точно будут использоваться в комбинации с химиотерапией, биологической терапией. В любом случае это будет комбинация, и вот тогда будет действительно скачок.
На каком уровне находятся отечественные разработке в сравнении с мировыми? Наше законодательство пока запрещает применять препараты с переменным составом и даже проводить клинические исследования для лечения. Но судя по научным публикациям, например в Nature, на западе проводились исследования на людях с глиобластомами еще в 2018 году…
И не только с глиобластомами. Одной из первых была статья про лечение меланом неоантигенными вакцинами. Дело в том, что мы находимся на том же уровне. Я не скажу, что мы превосходим, но мы не отстаем в уровне разработки. У нас все исследования до недавнего времени тормозились регуляторикой. В Европе, в США есть так называемые фаст-треки, то есть ускоренное продвижение препарата, минуя какие-то формальные вещи. А что касается неоантиантигенных вакцин, то в Европе применение этих препаратов просто разрешается консилиумом врачей клиники для определенного пациента. Единственно — эти вакцины должны быть изготовлены в соответствующих условиях.
Тем не менее в России поправки, регламентирующие производство препаратов переменного состава по инициативе ФМБА, приняты, и начнут действовать в сентябре. Какие еще сложности вы видите при производстве и применении персонализированной вакцины?
Действительно, поправки приняты, но пока к ним нет подзаконных актов — не ясно, какие требования Минздрав предъявит к производственным площадкам. Ведь не у каждого лечебного учреждения есть своя производственная площадка, где оно может делать эти препараты.
Более того, таких учреждений единицы, например — Онкоцентр Блохина, Федеральный центр мозга и технологий ФМБА России. В любом случае организовать у себя такое производство будет довольно затратно, хотя и возможно. Согласно новым поправкам, препарат должен производиться в том же учреждении, где находится больной. Скорее всего, это будут областные центры и может быть, специализированные онкологические учреждения.
Если онковакцина будет изготавливаться под каждого пациента индивидуально, значит ее производство нельзя будет масштабировать, значит ли это, что она заведомо будет дорогой, то есть лекарством для избранных?
Это часто задаваемый вопрос, но слово «масштабирование» здесь не подходит, потому что это не серийное производство. Сколько стоили первые персональные компьютеры? Очень дорого, сейчас же это абсолютно подъемная вещь. Услуга секвенирования генома человека когда-то составляла сотни тысяч рублей. Сейчас экзом человека можно секвенировать примерно за 30 тыс. рублей. В нашем случае, если говорить про персональные пептидные неоантигенные вакцины, возможно создание отечественных пептидных синтезаторов. Их цена будет снижаться, будут дешеветь материалы, то есть в любом случае это будет не элитный препарат.
Оценить стоимость можно?
Стоимость в основном будет складываться из цены секвенирования и синтеза пептидов. Думаю, само изготовление неоантигенной вакцины сейчас обойдется в пару сотен тысяч рублей, а сейчас есть лекарства и подороже. В любом случае, это точно не миллионы.
То есть, возможно, такое лечение будет доступно по ОМС?
Если будет организована сеть таких центров, то в перспективе — почему бы и нет?
Поэтому и надо регламентировать центры производства вакцин, чтобы кто попало их не делал на коленке?
Да, именно так. Именно в этом состоит сложная задача Минздрава. С одной стороны, нужно максимально разрешить новую технологию, а с другой стороны, нужно перекрыть доступ тем недобросовестным производителям, которые в подворотне готовы делать в качестве вакцин «отвары из лягушачьей шкуры».
Кстати, оборудование для производства пептидных неоантигенных вакцин не очень дорогое. Собственно, нужен пептидный синтезатор, компьютер, секвенатор.
Но они же у нас импортные?
Они импортные, но сейчас делают прототипы российских секвенаторов последнего поколения. Идут работы по созданию нанопорового секвенатора. А пептидный синтезатор- это более простой прибор, и сделать его совершенно несложно.
Можно предположить, когда онковакцины в нашей стране станут доступны пациентам?
В сентябре эти поправки вступят в силу. Не знаю, как быстро будут разработаны подзаконные акты, год может уйти на все регуляторные вопросы, приборы есть, производственные помещения, думаю, организовать несложно. Если будет оказана финансовая поддержка, думаю, что через два-три года онковакцины уже смогут найти применение на площадках тех организаций, которые уже существуют. Я думаю, что после того, как регуляторное давление ослабнет, к тематике будут привлекаться и отечественные частные инвесторы.